พันธะเคมี
ชนิดของพันธะเคมี
พันธะไอออนิก
พันธะไอออนิก ( Ionic bond ) หมายถึงแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมอะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก อะตอมที่มีค่าอิเลคโตรเนกาติวิตีน้อยจะให้อิเลคตรอนแก่อะตอมที่มีค่าอิเลคโตรเนกาติวิตีมาก และทำให้อิเล็กตรอนที่อยู่รอบๆ อะตอมครบ 8 (octat rule ) กลายเป็นไอออนบวก และไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น เช่น การเกิดสารประกอบ NaCl
จากตัวอย่าง Na ซึ่งมีวาเลนซ์อิเล็กตรอนเท่ากับ 1 ได้ให้อิเล็กตรอนแก่ Cl ที่มีวาเลนซ์อิเล็กตรอนเท่ากับ 7 จึงทำให้ Na และ Cl มีวาเลนซ์อิเล็กตรอนเท่ากับ 8 เกิดเป็นสารประกอบไอออนิก
สมบัติของสารประกอบไอออนิก
1. มีขั้ว เพราะสารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมาก ซึ่งยึดเหนี่ยวกันด้วยแรงยึดเหนี่ยวทางไฟฟ้า
2. ไม่นำไฟฟ้าเมื่ออยู่ในสภาพของแข็ง แต่จะนำไฟฟ้าได้เมื่อใส่สารประกอบไอออนิกลงในน้ำ ไอออนจะแยกออกจากกัน ทำให้สารละลายนำไฟฟ้าในทำนองเดียวกันสารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วยเนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเลคตรอนทำให้อิเลคตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3 . มีจุหลอมเหลวและจุดเดือดสูง ความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวต้องใช้พลังงานสูง
4 . สารประกอบไอออนิกทำให้เกิดปฏิกิริยาไอออนิก คือ ปฏิกิริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฏิกิริยาจึงเกิดทันที
5 . สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6. เป็นผลึกแข็ง แต่เปราะและแตกง่าย
2. ไม่นำไฟฟ้าเมื่ออยู่ในสภาพของแข็ง แต่จะนำไฟฟ้าได้เมื่อใส่สารประกอบไอออนิกลงในน้ำ ไอออนจะแยกออกจากกัน ทำให้สารละลายนำไฟฟ้าในทำนองเดียวกันสารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วยเนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเลคตรอนทำให้อิเลคตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3 . มีจุหลอมเหลวและจุดเดือดสูง ความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวต้องใช้พลังงานสูง
4 . สารประกอบไอออนิกทำให้เกิดปฏิกิริยาไอออนิก คือ ปฏิกิริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฏิกิริยาจึงเกิดทันที
5 . สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6. เป็นผลึกแข็ง แต่เปราะและแตกง่าย
การอ่านชื่อสารประกอบไออนิก
- กรณีเป็นสารประกอบธาตุคู่ ให้อ่านชื่อธาตุที่เป็นประจุบวก แล้วตามด้วยธาตุประจุลบ โดยลงท้ายเสียงพยางค์ท้ายเป็น “ ไอด์” (ide) เช่น
- กรณีเป็นสารประกอบธาตุมากกว่าสองชนิด ให้อ่านชื่อธาตุที่เป็นประจุบวก แล้วตามด้วยกลุ่มธาตุที่เป็นประจุลบได้เลย เช่น

- กรณีเป็นสารประกอบธาตุโลหะทรานซิชัน ให้อ่านชื่อธาตุที่เป็นประจุบวกและจำนวนเลขออกซิเดชันหรือค่าประจุของธาตุเสียก่อน โดยวงเล็บเป็นเลขโรมัน แล้วจึงตามด้วยธาตุประจุลบ เช่น
พันธะโควาเลนต์
พันธะโควาเลนต์ (Covalent bond) หมายถึง พันธะในสารประกอบที่เกิดขึ้นระหว่างอะตอม 2 อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีใกล้เคียงกันหรือเท่ากัน แต่ละอะตอมต่างมีความสามารถที่จะดึงอิเล็กตรอนไว้กับตัว อิเล็กตรอนคู่ร่วมพันธะจึงไม่ได้อยู่ ณ อะตอมใดอะตอมหนึ่งแล้วเกิดเป็นประจุเหมือนพันธะไอออนิก หากแต่เหมือนการใช้อิเล็กตรอนร่วมกันระหว่างอะตอมคู่ร่วมพันธะนั้นๆและมีจำนวนอิเล็กตรอนอยู่รอบๆ แต่ละอะตอมเป็นไปตามกฎออกเตต
เป็นพันธะที่เกิดจากการใช้อิเล็กตรอนข้างนอกร่วมกันระหว่างอะตอมของธาตุหนึ่งกับอีกธาตุหนึ่งแบ่งเป็น 3 ชนิดด้วยกัน
1. พันธะเดี่ยว (Single covalent bond )เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 อิเล็กตรอน เช่น F2 Cl2 CH4 เป็นต้น
2. พันธะคู่ ( Doublecovalent bond ) เกิดจากการใช้อิเล็กตรอนร่วมกันของธาตุทั้งสองเป็นคู่ หรือ 2 อิเล็กตรอน เช่น O2 CO2 C2H4 เป็นต้น
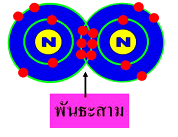
3. พันธะสาม ( Triple covalent bond ) เกิดจากการใช้อิเล็กตรอนร่วมกัน 3 อิเล็กตรอน ของธาตุทั้งสอง เช่น N2 C2H2 เป็นต้น
การอ่านชื่อสารประกอบโควาเลนซ์

- สารประกอบของธาตุคู่ ให้อ่านชื่อธาตุที่อยู่ข้างหน้าก่อน แล้วตามด้วยชื่อธาตุที่อยู่หลัง โดยเปลี่ยนเสียงพยางค์ท้ายเป็น “ ไอด์” (ide)
- ให้ระบุจำนวนอะตอมของแต่ละธาตุด้วยเลขจำนวนในภาษากรีก ดังตาราง
- ถ้าสารประกอบนั้นอะตอมของธาตุแรกมีเพียงอะตอมเดียว ไม่ต้องระบุจำนวนอะตอมของธาตุนั้น แต่ถ้าเป็นอะตอมของธาตุหลังให้อ่าน “ มอนอ” เสมอ

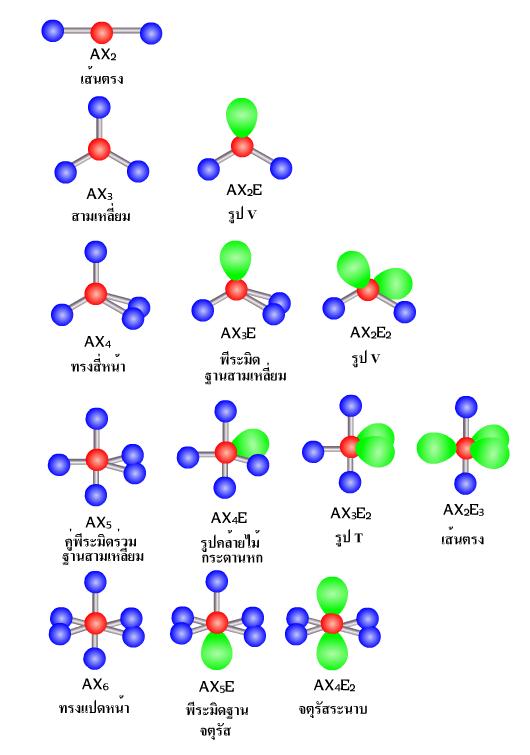
การพิจารณารูปร่างโมเลกุลโควาเลนต์
โมเลกุลโควาเลนต์ในสามมิตินั้น สามารถพิจารณาได้จากการผลักกันของอิเล็กตรอนที่มีอยู่รอบๆ อะตอมกลางเป็น สำคัญ โดยอาศัยหลักการที่ว่า อิเล็กตรอนเป็นประจุลบเหมือนๆ กัน ย่อมพยายามที่แยกตัวออกจากกนให้มากที่สุดเท่าที่จะกระทำได้ ดังนั้นการพิจารณาหาจำนวนกลุ่มของอิเล็กตรอนที่อยู่รอบๆ นิวเคลียสและอะตอมกลาง จะสามารถบ่งบอกถึงโครงสร้างของโมเลกุลนั้นๆได้โดยที่กลุ่มต่างๆ
- อิเล็กตรอนคู่โดดเดี่ยว
- อิเล็กตรอนคู่รวมพันธะได้แก่ พันธะเดี่ยว พันธะคู่ และพันธะสาม
ทั้งนี้โดยเรียงตามลำดับความสารารถในการผลักอิเลคตรอนกลุ่มอื่นเนื่องจากอิเลคตรอนโดดเดี่ยวและอิเลคตรอนที่ สร้างพันธะนั้นต่างกันตรงที่อิเล็กตรอนโดยเดี่ยวนั้นถูกยึดด้วยอะตอมเพียงตัวเดียว ในขณะที่อิเล็กตรอนที่ใช้สร้างพันธะถูกยึดด้วยอะตอม 2 ตัวจึงเป็นผลให้อิเลคตรอนโดดเดี่ยวมีอิสระมากกว่าสามารถครองพื้นที่ในสามมิตได้มากกว่า ส่วนอิเล็กตรอนเดี่ยวและอิเล็กตรอนคู่โดดเดี่ยว รวมไปถึงอิเล็กตรอนคู่ร่วมพันธะแบบต่าง ๆ นั้นมีจำนวนอิเลคตรอนไม่เท่ากันจึงส่งผลในการผลักอิเลคตรอนกลุ่มอื่นๆ ได้มีเท่ากัน โครงสร้างที่เกิดจกการผลักกันของอิเล็กตรอนนั้น สามารถจัดเป็นกลุ่มได้ตามจำนวนของอิเล็กรอนที่มีอยู่ได้ตั้งแต่ 1 กลุ่ม 2 กลุ่ม 3 กลุ่ม ไปเรื่อยๆ เรียกวิธีการจัดตัวแบบนี้ว่า ทฤษฎีการผลักกันของคู่อิเล็กตรอนวงนอก (Valence Shell Electron Pair Repulsion : VSEPR)
แรงยึดเหนี่ยวระหว่างโมเลกุล ( Van de waals interaction)
เนื่องจากโมเลกุลโควาเลนต์ปกติจะไม่ต่อเชื่อมกันแบบเป็นร่างแหอย่างพันธะโลหะหรือไอออนิก แต่จะมีขอบเขตที่แน่นอนจึงต้องพิจารณาแรงยึดเหนี่ยวระหว่างโมเลกุลด้วย ซึ่งจะเป็นส่วนที่ใช้อธิบายสมบัติทางกายภาพของโมเลกุลโควาเลนต์ อันได้แก่ ความหนาแน่น จุดเดือด จุดหลอมเหลว หรือความดันไอได้ โดยแรงยึดเหนี่ยวระหว่างโมเลกุลนั้นเกิดจากแรงดึงดูดเนื่องจากความแตกต่างของประจุเป็นสำคัญ ได้แก่
1. แรงลอนดอน ( London Force) เป็นแรงที่เกิดจากการดึงดูดทางไฟฟ้าของโมเลกุลที่ไม่มีขั้วซึ่งแรงดึงดูดทางไฟฟ้านั้นเกิดได้จากการเลื่อนที่ของอิเล็กตรอนอย่างเสียสมดุลทำให้เกิดขั้วเล็กน้อย และขั้วไฟฟ้าเกิดขึ้นชั่วคราวนี้เอง จะเหนี่ยวนำกับโมเลกุลข้างเคียงให้มีแรงยึดเหนี่ยวเกิดขึ้น
2. แรงดึงดูดระหว่างขั้ว (Dipole-Dipole interaction)เป็นแรงยึดเหนี่ยวที่เกิดระหว่างโมเลกุลที่มีขั้วสองโมเลกุลขึ้นไปเป็นแรงดึงดูดทางไฟฟ้าที่แข็งแรงกว่าแรงลอนดอน เพราะเป็นขั้นไฟฟ้าที่เกิดขึ้นอย่างถาวร โมเลกุลจะเอาด้านที่มีประจุตรงข้ามกันหันเข้าหากัน ตามแรงดึงดูดทางประจุ เช่น H2O HCl H2S และ CO เป็นต้น ดังภาพ
3. พันธะไฮโดรเจน ( hydrogen bond ) เป็นแรงยึดเหนี่ยวที่มีค่าสูงมาก โดยเกิดระหว่างไฮโดรเจนกับธาตุที่มีอิเล็กตรอนคู่โดดเดี่ยวเหลือ เกิดขึ้นได้ต้องมีปัจจัยต่างๆ ได้แก่ ไฮโดรเจนที่ขาดอิเล็กตรอนอันเนื่องจากถูกส่วนที่มีค่าอิเล็กโตรเนกาติวิตีสูงในโมเลกุลดึงไป จนกระทั้งไฮโดรเจนมีสภาพเป็นบวกสูงและจะต้องมีธาตุที่มีอิเลคตรอนคู่โดดเดี่ยวเหลือและมีความหนาแน่นอิเลคตรอนสูงพอให้ไฮโดรเจนที่ขาดอิเลคตรอนนั้น เข้ามาสร้างแรงยึดเหนี่ยวด้วยได้เช่น H2O HF NH3 เป็นต้น
พันธะโลหะ
พันธะโลหะ (Metallic Bond ) คือ แรงดึงดูดระหว่างไออนบวกซึ่งเรียงชิดกันกับอิเล็กตรอนที่อยู่โดยรอบหรือเป็นแรงยึดเหนี่ยวที่เกิดจากอะตอมในก้อนโลหะใช้เวเลนส์อิเล็กตรอนทั้งหมดร่วมกัน อิเล็กตรอนอิสระเกิดขึ้นได้ เพราะโลหะมีวาเลนส์อิเล็กตรอนน้อยและมีพลังงานไอออไนเซชันต่ำ จึงทำให้เกิดกลุ่มของอิเล็กตรอนและไอออนบวกได้ง่าย
พลังงานไอออไนเซชันของโลหะมีค่าน้อยมาก แสดงว่าอิเล็กตรอนในระดับนอกสุดของโลหะถูกยึดเหนี่ยวไว้ไม่แน่นหนา อะตอมเหล่านี้จึงเสียอิเล็กตรอนกลายเป็นไอออนบวกได้ง่าย เมื่ออะตอมของโลหะมารวมกันเป็นกลุ่ม ทุกอะตอมจะนำเวเลนซ์อิเล็กตรอนมาใช้ร่วมกัน โดยอะตอมของโลหะจะอยู่ในสภาพของไอออนบวก ส่วนเวเลนซ์อิเล็กตรอนทั้งหมดจะอยู่เป็นอิสระไม่ได้เป็นของอะตอมใดอะตอมหนึ่งโดยเฉพาะแต่สามารถเคลื่อนที่ไปได้ทั่วทั้งก้อนโลหะและเนื่องจากอิเล็กตรอนเคลื่อนที่เร็วมาก จึงมีสภาพคล้ายกับมีกลุ่มหมอกอิเล็กตรอนปกคลุมก้อนโลหะนี้นอยู่ เรียกว่า ทะเลอิเล็กตรอน โดยมีไอออนบวกฝังอยู่ในกลุ่มหมอกอิเล็กตรอนซึ่งเป็นลบ จึงเกิดแรงดึงดูดที่แน่นหนาทั่วไปทุกตำแหน่งภายในก้อนโลหะนั้น
สมบัติของโลหะ
- เป็นตัวนำไฟฟ้าได้ดี เพราะมีอิเล็กตรอนเคลื่อนที่ไปได้ง่ายทั่วทั้งก้อนของโลหะ แต่โลหะนำไฟฟ้าได้น้อยลงเมื่ออุณหภูมิสูงขึ้น เนื่องจากไอออนบวกมีการสั่นสะเทือนด้วยความถี่และช่วงกว้างที่สูงขึ้นทำให้อิเล็กตรอนเคลื่อนที่ไม่สะดวก
- โลหะนำความร้อนได้ดี เพราะมีอิเล็กตรอนที่เคลื่อนที่ได้ โดยอิเล็กตรอนซึ่งอยู่ตรงตำแหน่งที่มีอุณหภูมิสูง จะมีพลังงานจลน์สูง และอิเล็กตรอนที่มีพลังงานจลน์สูงจะเคลื่อนที่ไปยังส่วนอื่นของโลหะจึงสามารถถ่ายเทความร้อนให้แก่ส่วนอื่น ๆ ของแท่งโลหะที่มีอุณหภูมิต่ำกว่าได้
- โลหะตีแผ่เป็นแผ่นหรือดึงออกเป็นเส้นได้ เพราะไอออนบวกแต่ละไอออนอยู่ในสภาพเหมือนกันๆ กัน และได้รับแรงดึงดูดจากประจุลบเท่ากันทั้งแท่งโลหะ ไอออนบวกจึงเลื่อนไถลผ่านกันได้โดยไม่หลุดจากกัน เพราะมีกลุ่มของอิเล็กตรอนทำหน้าที่คอยยึดไอออนบวกเหล่านี้ไว้
- โลหะมีผิวเป็นมันวาว เพราะกลุ่มของอิเล็กตรอนที่เคลื่อนที่ได้โดยอิสระจะรับและกระจายแสงออกมา จึงทำให้โลหะสามารถสะท้อนแสงซึ่งเป็นคลื่นแม่เหล็กไฟฟ้าได้
- โลหะมีจุดหลอมเหลวสูง เพราะพันธะในโลหะ เป็นพันธะที่เกิดจากแรงยึดเหนี่ยวระหว่างวาเลนซ์อิเล็กตรอนอิสระทั้งหมดในด้อนโลหะกับไอออนบวกจึงเป็นพันธะที่แข็งแรงมาก
สื่อการสอน








ไม่มีความคิดเห็น:
แสดงความคิดเห็น